奈米化貽貝蛋白於醫療用仿生黏膠之應用
| 奈米化貽貝蛋白於醫療用仿生黏膠之應用 |
|
化工系 魏暘助理教授*、王瑜甄、高銓澤、簡廷翰 在外科手術進行過程中,人體組織的接合大多是以針線縫合或使用釘皮機利用鈦釘對組織進行釘合的方式處理,以防止體液由組織中滲漏與關閉傷口以利手術進行及術後組織修復。然而上述方式並不適用難以接近的身體區域或微創手術,同時對肝、脾、腎或肺等軟組織具創傷性,造成傷口往往不易快速癒合,癒後也容易留下不平整的疤痕,於是就開發出以合成或天然高分子作為組織黏著劑直接黏合傷口的相關研究1。而現今大多數醫用高分子黏著劑最主要的問題來自於潮濕環境下往往會因為介面間水分子的存在而降低或失去黏附能力,許多科學家轉而利用仿生技術來解決這項問題。自然界中的海洋生物如貽貝為了在潮間帶獲取豐富食物的同時可以對抗強勁的潮汐沖刷,因而演化出藉由分泌具黏性之特殊蛋白質,於液態環境中將自身固定在幾乎所有的有機與無機材料表面上2。在先前研究指出,這類的黏性蛋白具有生物相容性、高拉伸強度等優點,針對其在潮濕環境下保有的黏附特性,學術界則積極探討如何利用這類黏附蛋白作為醫用仿生黏膠的設計3, 4。
圖一、貽貝養殖系統: (a)生態缸與(b)貽貝養殖槽。
為了製備奈米化貽貝蛋白黏附顆粒,本團隊首先由實驗室飼養的藍貽貝 (Mytilus) (如圖一所示) 中直接萃取出黏附蛋白,接著以噴霧乾燥方式製備蛋白質奈米微粒,探討在潮濕環境下貽貝蛋白在奈米化後黏附特性的變化。貽貝會從殼內伸出一中空管狀構造的”足”狀組織,當貽貝的”足”接觸到適合的表面時,會藉由中空構造分泌出具黏性的貽貝足蛋白 (mussel foot protein) 並利用金屬離子與其他酵素蛋白進行交聯形成固化的蛋白質組織包含黏著板 (plaque),以及連接黏著板與貽貝本體的足絲 (byssus) 將貽貝在液態環境中固定於不同表面 (如圖二所示)。貽貝足蛋白經過酵素修飾後會將原有的酪胺酸 (tyrosine) 的酚官能基修飾成為3,4-二羥基苯丙氨酸 (L-3,4-dihydroxyphenylalanine, DOPA) 的官能基以進一步提升其黏附能力,例如DOPA既可以通過氧化成奎寧分子 (quinone) 或與鐵離子交聯後提升內聚力,也可以通過與不同基材表面形成氫鍵或金屬配位鍵結來增加黏附強度2, 4。
圖二、貽貝蛋白來源組織: (a)黏著板與(b)黏著板樣品。
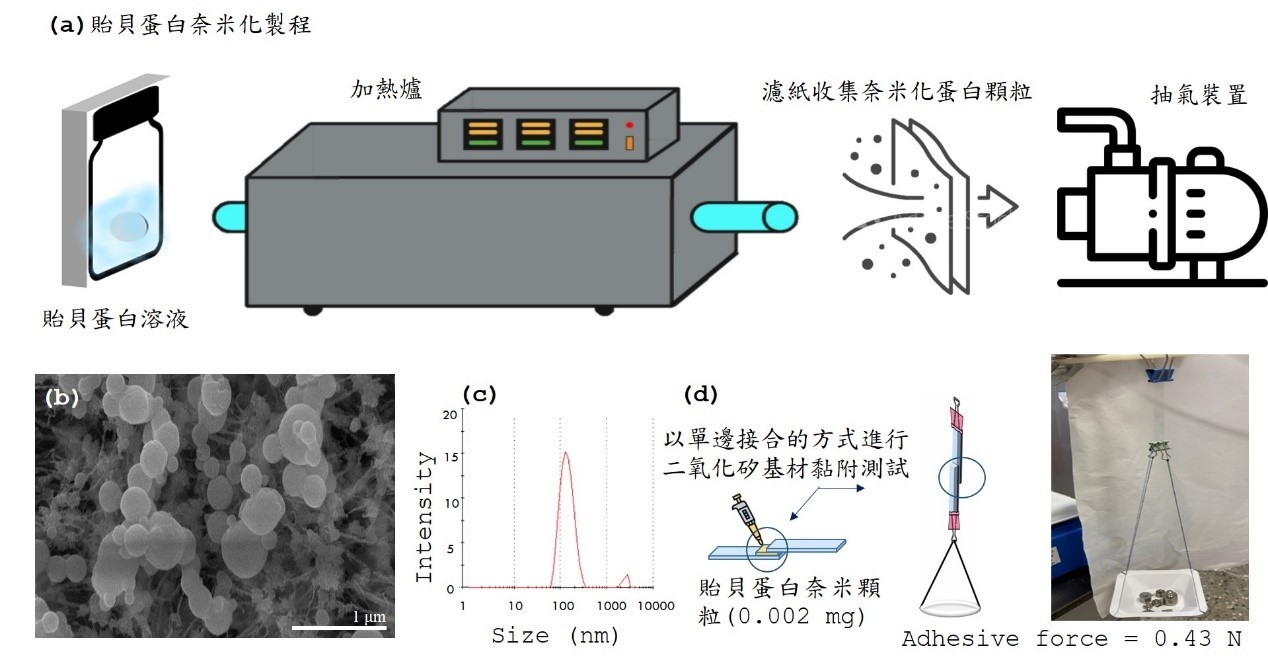
收集足夠的貽貝黏著板 (plaque) 後,本團隊使用組織研磨器在冰浴中進行貽貝蛋白萃取,接著取用適當濃度的蛋白溶液利用震盪器製備奈米微粒,並經由噴霧乾燥器將溶劑揮發後透過末端加裝抽器裝置收集尺寸均勻的奈米微粒至濾紙上,以電子顯微鏡進行顆粒尺寸的測定 (如圖三(b)所示)。最後透過在二氧化矽基材上以單邊接合的方式進行黏附性測試 (如圖三(d)所示)。結果顯示奈米化後的貽貝蛋白對於潮濕的二氧化矽基材所顯示的黏附能力是原有未奈米化貽貝黏附蛋白的十倍,顯示我們只需要原先十分之一量的黏附蛋白即可達到相同的黏附需求。本實驗室已初步掌握穩定萃取與純化各類貽貝黏附蛋白的基礎製程,未來實驗團隊將進一步探討不同奈米化製程對於貽貝蛋白黏膠開發在黏附特性以及製造成本上的影響,相信奈米化後的貽貝蛋白於醫療用仿生黏膠之應用上,除了上述的優點外,同時亦可做為藥物包覆的載體,在固定傷口的同時能進行穩定的藥物釋放,做為具仿生黏性的醫用奈米藥物釋放系統。
圖三、(a)貽貝蛋白奈米化流程與奈米顆粒特性分析:尺寸測試(b)電子顯微鏡與(c)動態光散射測試,與(d)貽貝蛋白奈米顆粒黏附性測試。
參考文獻 1. Matter, M. T.; Starsich, F.; Galli, M.; Hilber, M.; Schlegel, A. A.; Bertazzo, S.; Pratsinis, S. E.; Herrmann, I. K., Developing a tissue glue by engineering the adhesive and hemostatic properties of metal oxide nanoparticles. Nanoscale 2017, 9 (24), 8418-8426. 2. Waite, J. H., Mussel adhesion – essential footwork. The Journal of Experimental Biology 2017, 220 (4), 517-530. 3. Kheirabadi, B. S.; Pusateri, A. E.; Sondeen, J. L.; Delgado, A. V.; Modrow, H. E.; Hess, J. R.; Holcomb, J. B.; Army Inst Of Surgical Research Fort Sam Houston, T. X., Development of Hemostatic Dressings for Use in Military Operations. 2004. 4. Lee, B. P.; Messersmith, P. B.; Israelachvili, J. N.; Waite, J. H., Mussel-Inspired Adhesives and Coatings. Annu Rev Mater Res 2011, 41, 99-132. 5. Hwang, D. S.; Yoo, H. J.; Jun, J. H.; Moon, W. K.; Cha, H. J., Expression of Functional Recombinant Mussel Adhesive Protein Mgfp-5 in Escherichia coli. Applied and Environmental Microbiology 2004, 70 (6), 3352-3359. 6. Brubaker, C. E.; Messersmith, P. B., The Present and Future of Biologically Inspired Adhesive Interfaces and Materials. Langmuir 2012, 28 (4), 2200-2205. 7. Cao, Z.; Dobrynin, A. V., Nanoparticles as Adhesives for Soft Polymeric Materials. Macromolecules 2016, 49 (9), 3586-3592. 8. Rose, S.; Prevoteau, A.; Elzière, P.; Hourdet, D.; Marcellan, A.; Leibler, L., Nanoparticle solutions as adhesives for gels and biological tissues. Nature 2014, 505 (7483), 382-385. 9. Meddahi-Pellé , A.; Legrand, A.; Marcellan , A.; Louedec, L.; Letourneur, D.; Leibler, L., Organ Repair, Hemostasis, and In Vivo Bonding of Medical Devices by Aqueous Solutions of Nanoparticles. Angewandte Chemie International Edition 2014, 53 (25), 6369-6373.
|